Elektronai yra mažytės dalelės, suteikiančios atomams neigiamą krūvį. Be to, jie yra labai klastingi, todėl juos nelengva sekti. Šiame straipsnyje sužinosite, kaip rasti elektronus, suprasdami, kur jie gali slėptis, ir kokias gudrybes galite naudoti, kad atskleistumėte jų buvimo vietą. Suprasti, kur yra elektronai, labai svarbu chemikams ir kitiems mokslininkams, kurie turi tiksliai žinoti, kiek elektronų turi molekulė, prieš atlikdami jos savybių eksperimentus arba pradėdami kurti ją kaip naują medžiagą. Skaitytojams, kurie domisi chemija, bet nėra visiškai pasirengę universitetinio lygio chemijos studijoms, šis straipsnis tikriausiai nebus toks sudėtingas, kaip kitiems. Kaip skaičiuoti elektronus? Tačiau šiems skaitytojams vis tiek gali būti naudinga paskaityti apie tai, kaip chemikai sprendžia su elektronais susijusius uždavinius, kad jie galėtų geriau susipažinti su šia mokslo sritimi, jei kada nors ateityje ketina daryti karjerą gamtos mokslų srityje.
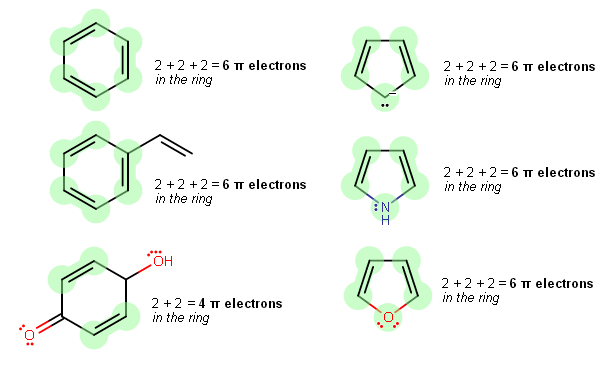
Kaip nustatyti elektronų skaičių atome?
Atomas yra mažiausias medžiagos vienetas, kuris gali jungtis su kitais atomais ir sudaryti molekules, iš kurių sudarytos visos gyvosios būtybės. Jį sudaro elektronai, skriejantys orbita aplink protonų ir neutronų branduolį. Pirmasis chemiko žingsnis nustatant elektronų skaičių atome – suskaičiuoti protonų skaičių atomo branduolyje. Atominis skaičius – tai protonų skaičius atomo branduolyje. Pagal atominį numerį nustatoma atomo rūšis arba cheminio elemento tipas, kuriam atomas priklauso. Kitas žingsnis – suskaičiuoti aplink branduolį skriejančių elektronų skaičių. Visų visatoje esančių atomų branduoliuose yra vienodas protonų skaičius – apie 100 milijardų milijardų milijardų (10). Tačiau elektronų, kurie yra neigiamos dalelės, egzistuojančios už branduolio ribų, būna įvairūs – nuo 0 iki 1836. Elektronų skaičius lemia konkretaus atomo chemines savybes.
Valentinių elektronų nustatymas
Naudingiausia sekti išoriniame energijos lygmenyje esančius elektronus arba valentinius elektronus. Būtent šie elektronai jungiasi su kitų elementų atomais ir sudaro junginius. Valentiniame lygmenyje esančius elektronus galima aptikti ieškant didžiausio teigiamo krūvio vietos. Tokiu būdu valentiniai elektronai yra tarsi saulė, kuri skleidžia šviesą ir šilumą iš tam tikros Saulės sistemos vietos. Valentinio lygmens elektronus paprastai traukia kitų atomų branduolių teigiami krūviai. Taigi, jei tam tikroje junginio vietoje randamas teigiamas krūvis, nuo šios vietos greičiausiai atstumiami elektronai yra iš tame junginyje esančių atomų valentinių elektronų.
Elektronų aptikimas branduolyje
Jei didžiausias teigiamas krūvis yra junginio centre, tai neigiami elektronai branduolyje tikriausiai yra atsakingi už kitų junginių valentinių elektronų atstūmimą. Jei teigiamas krūvis yra vienoje junginio pusėje, tai neigiami elektronai branduolyje tikriausiai yra atsakingi už kitų junginių valentinių elektronų pritraukimą. Kaip skaičiuoti elektronus? Branduolio elektronus galima aptikti taip pat, kaip ir teigiamąjį krūvį. Teigiamas branduolys atstums valentinius elektronus arba pritrauks valentinio lygmens elektronus. Jei teigiamas branduolys yra vienoje junginio pusėje, tai branduolio elektronai yra atsakingi už kitų junginių valentinių elektronų atstūmimą. Jei teigiamas branduolys yra viduryje, tai branduolio elektronai yra atsakingi už kitų junginių valentinio lygmens elektronų pritraukimą.
Naudojant elektronų užimtumo viltį (EEE) trūkstamiems elektronams rasti
Geriausias būdas išsiaiškinti, kokių elektronų trūksta junginyje, yra naudoti EEE metodą. E reiškia valentiniame lygmenyje esančius elektronus, o E – branduolyje esančius elektronus. EEE metodas veikia taip: pirmiausia nustatomas junginio tipas, tada ieškoma didžiausio teigiamo krūvio vietos ir galiausiai pagal traukos arba atstūmimo modelį nustatomi trūkstami elektronai. Pavyzdžiui, tarkime, turite junginį, kurio teigiamas krūvis yra viduryje. Tai užuomina, kad branduolyje esantys elektronai yra atsakingi už kitų junginių valentinių elektronų pritraukimą. Taigi, ieškote junginio, kurio viduryje yra didžiausias teigiamas krūvis. Junginys su didžiausiu teigiamu krūviu viduryje yra deguonis. O deguonis yra vienintelis junginys, turintis teigiamą krūvį viduryje.
Elektronų šokinėjimo triukas
Elektronai šokinėja nuo atomo prie atomo, kai sudaro ryšius tarp skirtingų junginių. Tačiau kai elektronas peršoka iš vieno atomo į kitą, kartais jis paliekamas. Kaip skaičiuoti elektronus? Taip dažniau nutinka, kai du atomai sudaro silpną ryšį, pavyzdžiui, kai vandenilis sudaro ryšį su deguonimi. Reakcijos metu, kai elektronai peršoka iš vieno atomo į kitą, trūkstamus elektronus galima nustatyti pagal tai, į kurią junginio pusę elektronas peršoko.
